- диаграмма состояния
- [phase equilibrium diagram] — геометрическое изображение фазовых равновесий при разных значениях термодинамических параметров: температуры, давления и концентраций компонентов в фазах. В случае систем, не содержащих газовую фазу, слабым влиянием давления на фазовые равновесия обычно пренебрегают, и диаграмму состояния строят в координатах «температура-химический состав». Диаграмму состояния металлических систем начали строить в конце XIX в. Экспериментальными методами, главным образом термическим, микроструктурным и рентгено-структурным анализами, построено около 2500 диаграмм состояния двухкомпонентных (двойных) систем и большое количество трехкомпонентных и более сложных многокомпонентных систем. Развиваются методы термодинамического расчета диаграмм состояния многокомпонентных систем, позволяющие резко уменьшить трудоемкость их построения. Диаграмму состояния двойных металлических систем строят при атмосферном давлении в координатах «температура — состав сплава».
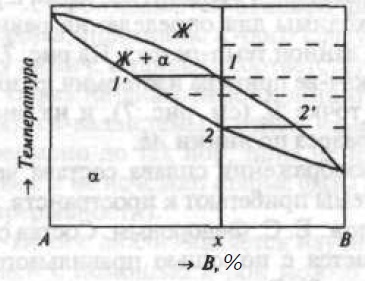
Рис. 1. Двухкомпонентная диаграмма состояния с неограниченной взаимной растворимостью компонентов в жидком и твердом состояниях
По оси составов на отрезке АВ откладывают (в процентах) концентрацию одного из компонентов. Концентрированные точки Линии Ае и Be являются ликвидусами соотвенно α- и β-фазы, а линии Аa и Вb — соотвенно их солидусам. Точка е, называемая эвтектической и принадлежащая обеим указанным линиям, изображает состав жидкого раствора, насыщенного одновременнно по отношению к α-фазе (состава точки a) и к β-фазе (состава точки b). Из жидкого раствора состава точки е кристаллизуется эвтектика: смесь фаз αa и βb(Же→αa + βb). Сплавы, состав которых находится левее е, называют доэвтектическими, а правее е — заэвтектическим Перитектическое равновесие Жp + αa + βb показано на рис. 3.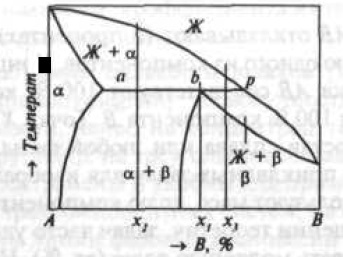
Рис. 3. Двухкомпонентная диаграмма состояния перитектического типа
В любом сплаве, состав которого находится между точками а и р, к концу первичной кристаллизации α-фазы жидкий раствор приобретает состав точки β, а α-фаза — состав точки а. Взаимодействие этих фаз приводит к образованию новой фазы β состава точки b. На диаграммах состояния монотектического типа (рис. 4)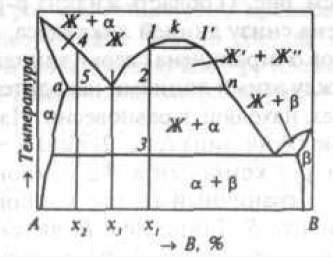
Рис. 4. Двухкомпонентная диаграмма состояния монотектического типа
куполообразная кривая mkn характеризует ограниченную растворимость компонентов в жидком состоянии ниже T. Во многих системах существуют промежуточные фазы (рис. 5).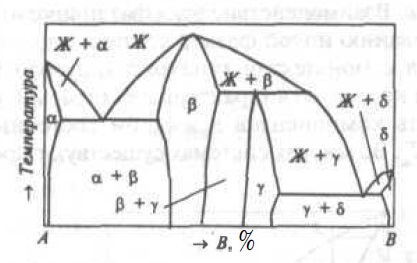
Рис.5. Двухкомпонентная диаграмма состояния с промежуточными фазами
Промежуточная фаза β образуется непосредственно из расплава, а промежуточная фаза γ-при перитектической кристаллизации (Жp + βb→γc). Область существования промежуточной фазы может быть столь узкая, что на диаграмме состояния эту фазу изображают в виде вертикали. На диаграммах состояния реальных систем можно встретить сочетания рассмотренных и других фазовых равновесий. Полиморфизм дополнительно усложняет вид диаграммы состояния (Смотри Диаграмма состояния Fe — C).
При построении диаграмм состояния трехкомпонентных систем прибегают к пространственному изображению линий и поверхностей равновесия. Состав отражается на плоскости в пределах равностороннего треугольника, а температуpa выносится в пространство по вертикалям, перпендикулярным к плоскости концентрационного треугольника. В целом тройная диаграмма состояния представляет трехгранную призму с основанием в форме равностороннего треугольника. Простейший тип ее с наличием тройной эвтектики представлен на рис. 6.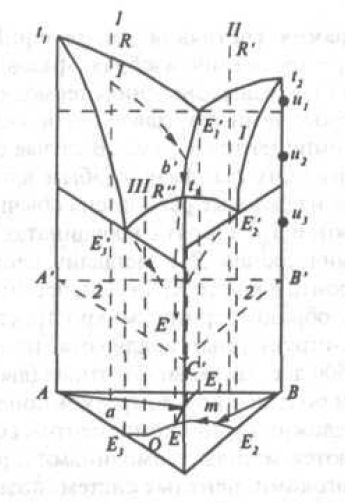
Рис. 6. Пространственное изображение тройной системы
На каждой из граней строят двойные системы А — В, В — С и А — С. Для перехода к тройной системе необходимо построение поверхностей, разделяющих фазовые области. В случае тройной эвтектической системы — поверхностей ликвидус. Через линии ликвидус t1E1'' и t1E'3 пройдет поверхность насыщения тройного жидкого раствора компонентом А (начальное выделение компонента А). Поверхность ликвидус, проходящая через линии t2E1'' и t2E2' соответствует насыщению жидкого раствора компонентом В, а через линии t3E2' и t3E3'' — компонентом С. Смежные поверхности насыщенного жидкого раствора пересекаются, образуя линии двойных эвтектик в тройной системе. Все три поверхности насыщения пересекаются в общей точке E' (точка тройной эвтектики). Детальное изучение тройной диаграмма состояния возможно только с помощью изотермических и политермических разрезов. Горизонтальные изотермические разрезы необходимы для определения равновесных при данной температуpе фаз.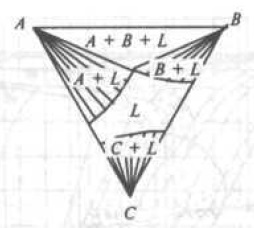
Рис. 7. Изотермический разрез диаграммы состояния тройной системы, соответствующей трехфазному равновесию А + B + α
На рис. 7 изображен в качестве примера изотермический разрез системы в точке U2 (Смотри рис. 7), и на рис. 8 вертикальный разрез по линии Ab.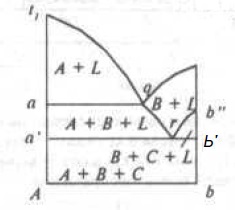
Рис.8. Разрез диаграммы состояния тройной системы по линии Ab
Для изображения сплава состава четверной системы прибегают к пространственному методу, предложенному Е. С. Федоровым. Состав сплава изображается с помощью правильного тетраэдра (рис. 9)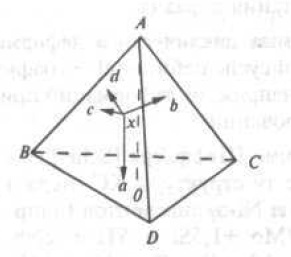
Рис. 9. Тетраэдр концентраций четверных сплавов
. Вершины углов соответствуют чистым компонентам. Ребра тетраэдра представляют концентрационные оси двойных систем, а грани-концентрационные треугольники тройных систем. Точка внутри тетраэдра определяет химический состав четверного сплава. Для изучения превращений в четверных системах также используют метод сечений. Каждый тетраэдр соответствует определенной температуpе. Диаграммы состояния строятся с помощью диаграмм «состав — свойство». Чем больше изучено зависимостей свойств от химического и фазового составов системы, тем точнее информация о диаграмме состояния. Диаграммы состояния и диаграммы «состав — свойство» являются основой физико-химического анализа, принципы которого следующие: каждому химическому индивиду соответствует геометрический образ на диаграмме (принцип соответствия); свойства системы в целом изменяются непрерывно до тех пор, пока не появляются новые и не исчезают старые фазы (принцип непрерывности). Физико-химический анализ является научной методологией с помощью которой можно разрабатывать материалы с заданными свойствами, а также режимы их синтеза и обработки. Он в равной степени применим как к органическим, так и неорганическим системам;
Смотри также:
— Диаграмма
— диаграмма Шеффлера
— диаграмма усталости
— диаграмма термокинетическая
— диаграмма рекристаллизации
— диаграмма растворимости
— диаграмма пластичности
— диаграмма плавкости шлаков
— кинетическая диаграмма усталости
— диаграмма деформации
— диаграмма изотермического превращения (С-диаграмма)
— диаграмма циклического деформирования
— диаграмма состояния железо — углерод
— диаграмма прессования
— диаграмма предельных амплитуд
— диаграмма предельной пластичности Келлера — Гудвина
— диаграмма пластичности Колмогорова — Богатова
Энциклопедический словарь по металлургии. — М.: Интермет Инжиниринг. Главный редактор Н.П. Лякишев. 2000.
